 |
 |
 |
 |
 |
 |
 |
 |
��606-8507
���s�s�����搹��@�쌴��53
���s��w iPS�זE������
�Տ����p��������
�_�o���������� |

![�]�_�o�O��](../img/banner02.gif)

|
|
 |
�����̗���
- �p�[�L���\���a�ɂ���
- �p�[�L���\���a���Ăǂ�ȕa�C�H
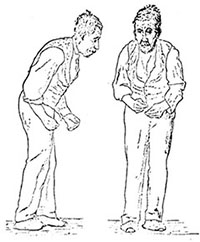 �}1. �E�B���A���E���`���[�h�E�K���[�Y���ɂ��p�[�L���\���a�̃C���X�g�i1886�N�j �}1. �E�B���A���E���`���[�h�E�K���[�Y���ɂ��p�[�L���\���a�̃C���X�g�i1886�N�j
�@���̕a�C�͎��50�Έȍ~�ɔ��ǂ�����̂ŁA1000�l��1�`1.5�l���炢����ƌ����Ă��܂��B�̂̐k����ؓ��̂����A���삪�ɖ��ɂȂ�Ƃ������Ǐm���Ă��܂��B
- �ǂ����ăp�[�L���\���a�ɂȂ��Ă��܂��̂��H
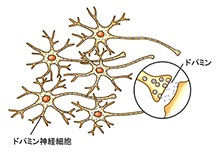
�@�]�̒��̍����ƌĂ��ꏊ�ɂ�������h�p�~���i�h�[�p�~���Ƃ������܂��j������_�o�זE�������ƂȂ��Ă��܂��B�h�p�~���́A�h�p�~���_�o�זE�̒��ō���Ď����̐�[����זE�̊O�ւƕ��o����A�ʂ̐_�o�זE�Ɏ���܂��B����ɂ��A�_�o�̐M�������̐_�o�ւƓ`�����܂��B
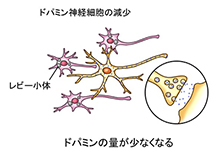
�@�������A�p�[�L���\���a�̊��҂���ł́A�h�p�~���_�o�זE�̒��Ɉُ�ȃ^���p�N���̉�i���r�|���́j���݂���悤�ɂȂ�A���̂��߂ɍזE������ł��܂��܂��B�������ăh�p�~���_�o�זE���������Ă������Ƃɂ��A�]���ŎY�������h�p�~�������Ȃ��Ȃ��Ă��܂��܂��B�����āA�h�p�~���_�o�זE�����葱�������ʁA����ȏꍇ��20-30%���炢�܂Ō����Ă��܂��ƁA�Ǐ����ƌ����Ă��܂��B
 |  | | �}2.���N�ȏ�Ԃ̃h�p�~���_�o�זE | �}3.�p�[�L���\���a���҂���̃h�p�~���_�o�זE |
- �p�[�L���\���a�̎��Ö@
�@���݂̎��Ö@�̒��S�I�Ȃ��̂́A������ނ��Ƃő���Ȃ��Ȃ����h�p�~�����[������@�ł��B�h�p�~�����̂��̂�����ł��]�̒��ɂ͓͂��Ȃ����߁A�h�p�~��������ޗ��ƂȂ郌�{�h�p�iL-�h�p�Ƃ������܂��j�����݁A�h�p�~���_�o�זE���Ńh�p�~������点�܂��B���ǂ���ƒ����ɓn���Ė�����ނ��ƂɂȂ�̂ł����AL-�h�p����h�p�~�������̂̓h�p�~���_�o�זE�Ȃ̂ŁA�a�C�̐i�s�ƂƂ��Ƀh�p�~���_�o�זE�����葱����ƃh�p�~�������܂�����Ȃ��Ȃ�A����Ɩ����ɂ����Ȃ�܂��B����ɖ�̌������Ԃ͒Z���Ȃ�A�ߏ�Ɉ��ނƎ葫���������ɓ����Ă��܂�����p�i�W�X�L�l�W�A�j���o�Ă��܂��B
�@�����P�̎��Ö@�́A�O�Ȏ�p�ɂ��]�̒��ɓd�ɂߍ���ŁA�d�C�I�Ȏh���ɂ��_�o��H�̗���߂��āA�̂̓����𑣂����̂ł��i�]�[���h���Ö@�GDBS��p�j�B�������A������a�C�̐i�s��}����킯�ł͂Ȃ��A���ʂ͎���ɔ���Ă䂫�܂��B
�@������̏ꍇ���A�Ǐ���ꎞ�I�Ɋɘa����悤�ȑΏǗÖ@�ł����Ȃ��A�p�[�L���\���a�̍��{�I�Ȏ��Ö@�͖�������܂���B
- ����܂ł̍זE�ڐA���Ì����Ɖۑ�ɂ���
- �זE���ڐA���邱�ƂŃp�[�L���\���a�����Âł���\���Ɖۑ�
�@���{�I�Ȏ��Ö@���Ȃ�����Ɏ��łׂ��A�h�p�~���_�o�זE���̂��̂��ڐA���悤�Ƃ������݂��Ȃ����悤�ɂȂ�܂����B1980�N�㖖����X�E�F�[�f����A�����J�A�J�i�_�Ȃǂőَ��̐_�o�זE���ڐA����Տ������i���҂���̑̂ł̌��ʂ����������j���s���܂����B�D�P���₳�ꂽ�َ��̔]���́A�h�p�~���_�o�זE���������镔�ʁi���]�����j�����o���A�זE�����ɂ��A���ڊ��҂���̔]�ɈڐA����Ƃ������̂ł����B��400��̗Տ��������s���A�����x�E�y�x�̊��҂���ɂ͏Ǐ�̉��P�������A20�N�Ԍ��ʂ����������Ƃ����Ǘ������Ă��܂��B���̈���ŁA����ɑ̂��������Ă��܂��悤�ȕ���p�i�W�X�L�l�W�A�j���o���P�[�X������܂����B
�@�܂��A���̎��Ö@�ɂ͒���َ���p���邱�Ƃ�A��x�̈ڐA�ɕK�v�ȍזE���W�߂邽�߂ɂ͕����̒���َ����K�v�ŏ\���ȍזE�邱�Ƃ�����Ƃ�������������܂����B
- iPS/ES�זE���g�����זE�ڐA���Â�ڎw��������
�@�َ��R���̍זE�ł͂Ȃ��A�����Ƒ�ʂɏW�߂���זE�Ƃ���ES�זE��iPS�זE�Ƃ��������\�����זE�����ڂ���܂����B�����̍זE�͂قږ����ɑ��B����\�͂����邽�߁A������ł����₷���Ƃ��ł��܂��B����iPS�זE�͊��҂��g�̍זE�����邱�Ƃ��o���܂��BiPS/ES�זE����h�p�~���_�o�זE������A���҂���ɈڐA���鎡�Â�ڎw�����������i�߂��܂������A�זE�ڐA���Â��s�����߂ɂ͂������������ׂ��ۑ肪����܂����B
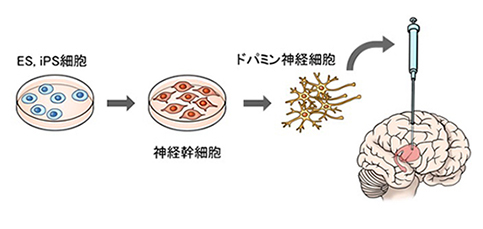 �}4. ES/iPS�זE�𗘗p�����p�[�L���\���a�̍זE�ڐA���� �}4. ES/iPS�זE�𗘗p�����p�[�L���\���a�̍זE�ڐA����
- �������q���܂܂Ȃ��_�o�U�����@
�@iPS/ES�זE��|�{����ۂɂ́A�t�B�[�_�[�זE�ƌĂ��l�Y�~�R���̍זE�ƈꏏ�ɔ|�{����K�v������܂����B�܂��A�|�{�t���ɂ̓E�V�̌������g���Ă��܂����B�������������R���̐����͖��m�̊����ǂȂǂ̉\����r�����邱�Ƃ��e�Ղł͂Ȃ��̂ŁA�ڐA�p�̍זE�ɂ��������̂܂g�����Ƃ͏o���܂���B�������q���܂܂Ȃ����@�ōזE��|�{������@�̊J�����K�v�ł��B
- �ߏ�ȑ��B��}�����邽�߂̍זE�I��
iPS/ES�זE�͖����ɑ��B����\�͂�����A�����̍זE�����̂܂ܑ̂̒��ɓ���ƁA���B�𑱂��Ď�ᇁi�זE�̉�j���`�����Ă��܂��\��������܂��B���ÂɕK�v�ȃh�p�~���_�o�זE������I�тƂ���@�̊J�����K�v�ł��B
- �ڐA�זE�̐����Ƌ@�\�̈ێ�
�@�̂̊O�ō�������̂���肭�̂̒��ɂƂǂ܂��ċ@�\���邩�ǂ����͂ƂĂ���ł��B�ڐA�����h�p�~���_�o�זE�����₳��邱�ƂȂ��]���ɐ�����������������悤�ȈڐA���@��ڐA�ꏊ���������邱�Ƃ��K�v�ł��B
- �������ʂƈ��S���m�F
�@���Ö@�Ƃ��Ċm�����邽�߂ɂ́A�ڐA�����זE�������Ԃɂ킽���ċ@�\����̂��A���邢�͈��S�����m�ۂł��Ă��邩�ǂ����̌����K�v�ł��B
- �����~�������ł̌����̗���ɂ���
�@�p�[�L���\���a�̍זE���ÂɌ����āA����܂łɗl�X�Ȍ������ʂ\���Ă��܂����B��q��i�`iv�̉ۑ���������A�Տ����p�Ɏg�p����זE�̍쐻���@���m�����܂����B
- �������q���܂܂Ȃ��_�o�U�����@
�@�ȑO�̓t�B�[�_�[�זE�ƌĂ��}�E�X�̍זE��p���Đ_�o�����U�����s���Ă��܂������ABMP�V�O�i����Activin/Nodal�V�O�i����j�Q����ᕪ�q�������𗘗p���邱�ƂŁA�}�E�X�t�B�[�_�[�זE���g�킸�ɁA�q�giPS/ES�זE�������悭�_�o�זE�ւƕ��������邱�Ƃɐ������܂���(�X���� 2011)�B
�@�܂��AiPS/ES�זE�͈�ʂɃ}�E�X�t�B�[�_�[�זE�ƈꏏ�ɔ|�{����Ă��܂������A���̕��@�ł͎������삪�ώG�ł����A�ڐA�זE�Ƀ}�E�X�̍זE���c���Ă��܂��\��������܂��B�����ŁA���~�j���Ƃ����זE���m���Ȃ������ȃ^���p�N���̈ꕔ��p���A����ɐV�����|�{�t�̊J���Ȃǂ��s���āA�t�B�[�_�[�זE���Ȃ��Ă�iPS/ES�זE��|�{�ł�����@���J�����܂���(����� 2014�GCiRA�R���搶�A����w ���搶�Ƃ̋�������)�B
- ���S�ȍזE�ڐA���s�����@�̊J��
�@ 2007�N�ɔ��\���ꂽ�q�giPS�זE�̍쐻���@�ł́A4�̈�`�q�����g���E�C���X�ōזE���ɓ������Ă��܂����B���̕��@�ł͓���������`�q�����F�̂ɑg�ݍ��܂�܂����A�g�ݍ��܂��ꏊ���I�ׂȂ����߂ɉ^�������̈�`�q���Ă��܂��A��������\��������܂����B�����ŁA���F�̂ɑg�ݍ��܂�邱�Ƃ̂Ȃ��G�s�\�[�}���v���X�~�h���g���Ĉ�`�q�����邱�Ƃň�`�q�ω��̏��Ȃ��q�giPS�זE������������@���J�����܂���(���c�� 2011�GCiRA�R���搶�Ƃ̋�������)�B
�@�_�o�����U���@�����ǂ��邱�Ƃɂ��_�o�����̌��������サ�i�@�ɋL�ځF�X���� 2011)�AiPS�זE�̎c�����݂��Ȃ��Ȃ�܂����B����ɕ����U�������̍זE�̈ڐA�������s���A�����]���ōזE�����B����\��������Ƃ������͏����̐_�o���זE�ł��邱�ƁA�����͕��ː��Ɋ������邱�Ƃ𖾂炩�ɂ��܂���(����� 2016)�B
�@���ÂɕK�v�Ȓ��]�h�p�~���_�o�זE�͂��炾�̕����ɂ����ƌĂ��g�D���甭�����A���̒�ł̓R�����Ƃ����^���p�N�������Ă��܂��B���̃R������p���čזE��I�ʂ�����@���J�����A�����_�o���זE���������Ē��]�h�p�~���_�o�זE��Z�k���邱�Ƃɐ������܂����B����ɂ����S���L���A����ɋώ��ȍזE�̈ڐA���\�ɂȂ�܂���(�y��� 2014�G�J�������� ����搶�Ƃ̋�������)�B
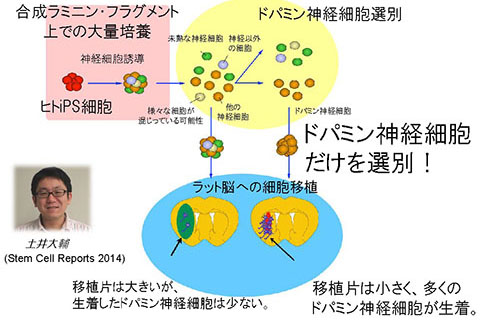 �}5. �h�p�~���_�o�זE�̐������@ �}5. �h�p�~���_�o�זE�̐������@Doi D, et al., Stem Cell Reports 2 (3): 337–50. 2014
- �ڐA�זE�̐������悭������@�̊J��
�@ �זE�̐�����@�\�����߂�ɂ͈ڐA��̔]�i�z�X�g�]�j�̊����d�v�ł��B���Ƀp�[�L���\���a�̎��Ö�Ƃ��Ďg�p����Ă���]�j�T�~�h���}�E�XiPS�זE�R���h�p�~���_�o�זE�̐��������コ���邱�Ƃ𖾂炩�ɂ��܂���(�g��� 2013)�B�܂��A�זE�����̂悢�]���ƈ����]���̈�`�q������ԗ��I�ɔ�r��͂��邱�Ƃɂ���āAiPS�זE�R���h�p�~���_�o�זE�̐����𑣐i����V���ȕ��qNXPH3�肵�܂���(������ 2015)�B����ɁA���]�����̃h�p�~���_�o�זE���瓊�˂��Ă���_�o�זE����͂��邱�Ƃɂ���āA�C���e�O������5��1���V�i�v�X�`���Ɋւ���Ă���\�������邱�ƁA���z�������G�X�g���W�I�[�����C���e�O������5��1�������������ڐA�����זE�ƃz�X�g���̐_�o�זE�Ƃ̃V�i�v�X�`���𑣐i�����邱�Ƃ𖾂炩�ɂ��܂���(������ 2016)�B���̂悤�ɖ��^�Ƒg�ݍ��킹�邱�Ƃɂ���ăz�X�g�]�������K�����A�זE�ڐA�̌��ʂ����߂邱�Ƃ��������Ă��܂��B
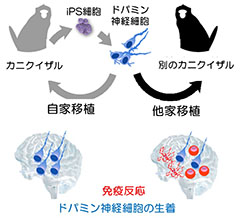 �}6. ���ƁE���ƈڐA�ɂ��Ɖu�����̈Ⴂ �}6. ���ƁE���ƈڐA�ɂ��Ɖu�����̈ႢMorizane A, et al., Stem Cell Reports 1 (4): 283–92. 2013
�@�܂��ACiRA�ł͖Ɖu�̌^�ł���HLA�^���z���ڍ��̂Ƃ��Ď����N�ȕ�����iPS�זE���쐻���A�\�߃X�g�b�N���Ă������ƂŁA���Ȃ���ނ̍זE�ł������̕��ɋ��┽�������Ȃ��ڐA���邱�Ƃ��ł���悤�ɂ���A�Đ���×piPS�זE�X�g�b�N�v���W�F�N�g��i�߂Ă��܂��B�T���̖Ɖu�̌^�ł���MHC�i�q�g�ł�HLA�ɑ�������j���z���ڍ��̂Ƃ��Ď��J�j�N�C�U������iPS�זE���쐻���A�h�p�~���_�o�זE�ւƕ��������܂����B����MHC�����T���Ɠ���MHC�������Ȃ��T���ɂ��ꂼ��ڐA���A�Ɖu�����̈Ⴂ�������܂����BMHC���s�K���̏ꍇ�͖Ɖu�����������N������邱�ƁAMHC��K���������ق����Ɖu�������}�����邱�Ƃ����炩�ɂȂ�܂����B�܂��A�Ɖu�}���܂𓊗^���邱�ƂŁAMHC���K�����Ȃ��ꍇ�ł��K���������ꍇ�Ɠ����x�ɂ܂ŖƉu�����͗}���ł��邱�Ƃ�������܂����i�X���� 2017�j�B
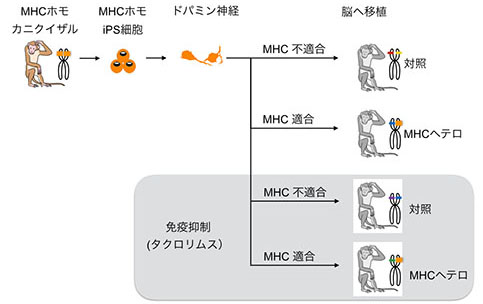 �}7. MHC�K���ɂ��Ɖu�����ւ̉e�����������錤���̊T�� �}7. MHC�K���ɂ��Ɖu�����ւ̉e�����������錤���̊T��Morizane, A., et al., Nature Communications 8, 385, 2017
- �ڐA�זE�̒������ʂƈ��S���̊m�F
�@iPS�זE�����\�����1�N�O��2005�N�A�J�j�N�C�U����ES�זE����쐻�����h�p�~���_�o�זE���p�[�L���\���a���f���i�p�[�L���\���a�̏Ǐ݂���j�J�j�N�C�U���̔]���ɈڐA���A�p�[�L���\���a�Ǐ��P���邱�Ƃ𐢊E�ɐ�삯�ďؖ����܂���(���� 2005)�B����Ƀq�gES�זE��p���ĈڐA��1�N�Ԃ̌o�ߊώ@���s���A��͂�J�j�N�C�U�����f���̐_�o�Ǐ��P���邱�Ƃ𖾂炩�ɂ��܂����B�����̃T���ł͎�ᇌ`���͔F�߂��܂���ł���(�y��� 2012)�B�܂��A�q�giPS�זE�R���h�p�~���_�o�זE�ł��A���Ȃ��Ƃ�6�����͗ǍD�Ȑ����������邱�Ƃ��m�F���܂���(�e�n�� 2011)�B
�@ii�ŏq�ׂ��悤�ɗՏ��p�̍זE�����@���m�������̂Łi�y��� 2014�j�A���̐����@�ō쐻�����q�giPS�זE�R���h�p�~���_�o�זE�̗L�����ƈ��S�����A�p�[�L���\���a���f���̃J�j�N�C�U����p���Č����܂����B�ڐA�זE����ڐA���@�ȂǁA���ۂ̗Տ������̃V�~�����[�V�����Ƃ��čזE�ڐA�������s�����Ƃ���A�ڐA��̍s����͂Ńp�[�L���\���a�̏Ǐ��P���Ă��邱�Ƃ����炩�ɂȂ�܂����B�܂��A�ڐA�����זE���]���ɐ������ċ@�\���Ă��邱�Ƃ�MRI��PET�摜��p���Ē��ׂ�Z�p���m�����A���Ȃ��Ƃ��ڐA��2�N�Ԃ͔]���Ŏ�ᇂ��`�����Ȃ����Ƃ��m�F���܂����i�e�n�� 2017�j�B
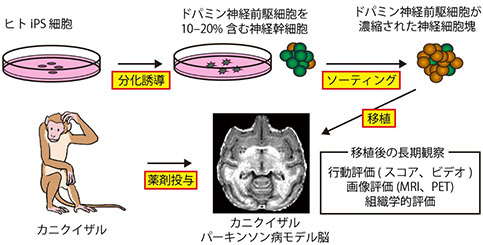 �}8. �J�j�N�C�U���p�[�L���\���a���f���ւ̍זE�ڐA �}8. �J�j�N�C�U���p�[�L���\���a���f���ւ̍זE�ڐAKikuchi, T., et al., Nature 548, 592–96. 2017
�@�����̌��ʂ���A�q�giPS�זE����U�������h�p�~���_�o�זE�͎�ᇌ`�������������ƂȂ��_�o�Ǐ�̉��P�������炷���Ƃ����҂ł���ƍl���Ă��܂��B
���f�ژ_���Ɋւ�����
- Nakagawa M, Taniguchi Y, Senda S, Takizawa N, Ichisaka T, Asano K, Morizane A, Doi D, Takahashi J, Nishizawa M, Yoshida Y, Toyoda T, Osafune K, Sekiguchi K, Yamanaka S. 2014. “A Novel Efficient Feeder-Free Culture System for the Derivation of Human Induced Pluripotent Stem Cells.” Scientific Reports 4. doi:10.1038/srep.03594.
- Morizane A, Doi D, Kikuchi T, Nishimura K, Takahashi J. 2011. “Small-Molecule Inhibitors of Bone Morphogenic Protein and Activin/nodal Signals Promote Highly Efficient Neural Induction from Human Pluripotent Stem Cells.” Journal of Neuroscience Research 89 (2): 117–26. doi:10.1002/jnr.22547.
- Okita K, Matsumura Y , Sato Y, Okada A, Morizane A, Okamoto S, Hong Hyenjong, Nakagawa M, Tanabe K, Tezuka K, Shibata T, Kunisada T, Takahashi M, Takahashi J, Saji H, Yamanaka S. 2011. “A More Efficient Method to Generate Integration-Free Human iPS Cells.” Nature Methods 8 (5): 409–12. doi:10.1038/nmeth.1591.
- Katsukawa M, Nakajima Y, Fukumoto A, Doi D, Takahashi J. 2016. “Fail-safe therapy by gamma-ray irradiation against tumor formation by human induced pluripotent stem cell-derived neural progenitors.” Stem Cells and Development 25 (11): 815–25. doi:10.1089/scd.2015.0394.
- Doi D, Samata B, Katsukawa M, Kikuchi T, Morizane A, Ono Y, Sekiguchi K, Nakagawa M, Parmar M, Takahashi J. 2014. “Isolation of Human Induced Pluripotent Stem Cell-Derived Dopaminergic Progenitors by Cell Sorting for Successful Transplantation.” Stem Cell Reports 2 (3): 337–50. doi:10.1016/j.stemcr.2014.01.013.
- Samata B, Doi D, Nishimura K, Kikuchi T, Watanabe A, Sakamoto Y, Kakuta J, Ono Y, Takahashi J. 2016. “Purification of functional human ES and iPSC-derived midbrain dopaminergic progenitors using LRTM1.” Nature Communications 7: 13097. doi:10.1038/ncomms.13097.
- Yoshikawa T, Samata B, Ogura A, Miyamoto S, Takahashi J. 2013. “Systemic administration of valproic acid and zonisamide promotes differentiation of induced pluripotent stem cell–derived dopaminergic neurons.” Frontiers in Cellular Neuroscience 7: 11. doi:10.3389/fncel.2013.00011.
- Nishimura K, Murayama S, Takahashi J. 2015. “Identification of Neurexophilin 3 as a novel supportive factor for survival of induced pluripotent stem cell-derived dopaminergic progenitors.” Stem Cells Translational Medicine 4 (8): 932–44. doi:10.5966/sctm.2014-0197.
- Nishimura K, Doi D, Samata B, Murayama S, Tahara T, Onoe H, Takahashi J. 2016. “Estradiol facilitates functional integration of induced pluripotent stem cell-derived dopaminergic neurons into striatal neuronal circuits via activation of integrin α5β1.” Stem Cell Reports 6 (4): 511–24. doi:10.1016/j.stemcr.2016.02.008.
- Morizane A, Doi D, Kikuchi T, Okita K, Hotta A, Kawasaki T, Hayashi T, Onoe H, Shiina T, Yamanaka S, Takahashi J. 2013. “Direct Comparison of Autologous and Allogeneic Transplantation of iPSC-Derived Neural Cells in the Brain of a Nonhuman Primate.” Stem Cell Reports 1 (4): 283–92. doi:10.1016/j.stemcr.2013.08.007.
- Takagi Y, Takahashi J, Saiki H, Morizane A, Hayashi T, Kishi Y, Fukuda H, Okamoto Y, Koyanagi M, Ideguchi M, Hayashi H, Imazato T, Kawasaki H, Suemori H, Omachi S, Iida H, Itoh N, Nakatsuji N, Sasai Y, Hashimoto N. 2005. “Dopaminergic Neurons Generated from Monkey Embryonic Stem Cells Function in a Parkinson Primate Model.” Journal of Clinical Investigation 115 (1): 102–9. doi:10.1172/JCI200521137.
- Doi D, Morizane A, Kikuchi T, Onoe H, Hayashi T, Kawasaki T, Motono M, Sasai Y, Saiki H, Gomi M, Yoshikawa T, Hayashi H, Shinoyama M, Mohamed R, Suemori H, Miyamoto S, Takahashi J. 2012. “Prolonged Maturation Culture Favors a Reduction in the Tumorigenicity and the Dopaminergic Function of Human ESC-Derived Neural Cells in a Primate Model of Parkinson’s Disease.” Stem Cells 30 (5): 935–45. doi:10.1002/stem.1060.
- Kikuchi T, Morizane A, Doi D, Onoe H, Hayashi T, Kawasaki T, Saiki H, Miyamoto S, Takahashi J. 2011. “Survival of Human Induced Pluripotent Stem Cell–Derived Midbrain Dopaminergic Neurons in the Brain of a Primate Model of Parkinson’s Disease.” Journal of Parkinson’s Disease 1 (4): 395–412. doi:10.3233/JPD-2011-11070.
 |
|